A atividade das enzimas depende diretamente da forma que suas cadeias polipeptídicas assumem no espaço. Como essa conformação é sensível à temperatura, experimentos simples, como o que avalia a catalase em diferentes condições, permitem observar como uma mudança no ambiente altera o desempenho de uma proteína. Esse tipo de análise, que envolve interpretar dados experimentais e relacionar fenômenos bioquímicos a processos fisiológicos, está dentro do foco do ENEM. A seguir, a resolução comentada e didática da questão sobre a ação da catalase em diferentes temperaturas.
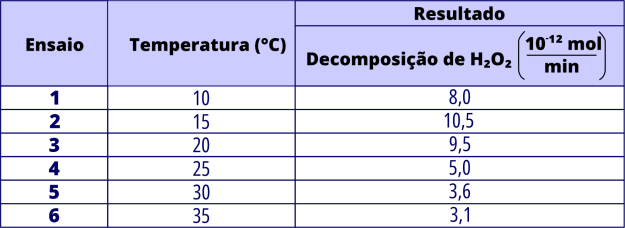
Em uma aula prática de bioquímica, para medir a atividade catalítica da enzima catalase, foram realizados seis ensaios independentes, nas mesmas condições, variando-se apenas a temperatura. A catalase decompõe o peróxido de hidrogênio (H2O2), produzindo água e oxigênio. Os resultados dos ensaios estão apresentados no quadro.
Os diferentes resultados dos ensaios justificam-se pelo(a)
A) variação do pH do meio.
B) aumento da energia de ativação.
C) consumo da enzima durante o ensaio.
D) diminuição da concentração do substrato.
E) modificação da estrutura tridimensional da enzima.
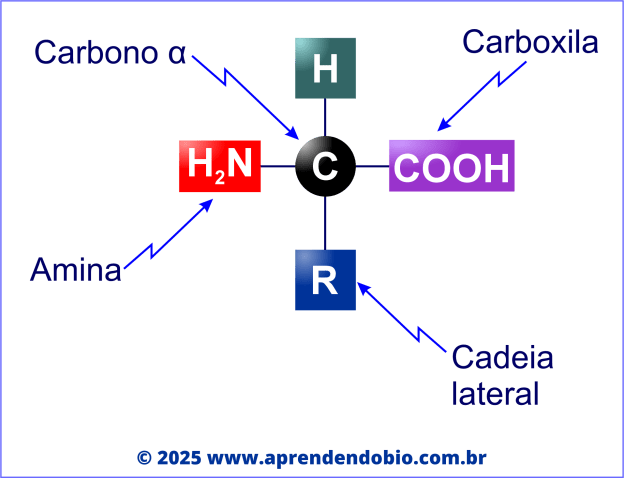
As proteínas são macromoléculas formadas pela união de aminoácidos, que são suas unidades estruturais fundamentais. Cada aminoácido apresenta uma estrutura molecular padronizada, composta por um carbono central, denominado carbono alfa, ao qual se ligam quatro grupos diferentes: uma amina (-NH₂), uma carboxila (-COOH), um hidrogênio e uma cadeia lateral (R). Esta última é a responsável pela diferenciação e pelas propriedades específicas de cada aminoácido. A figura a seguir ilustra e estrutura de um aminoácido.
Embora a natureza contenha diversas moléculas que podem ser classificadas como aminoácidos, apenas vinte deles são utilizados diretamente pelos organismos na construção de proteínas. Estes aminoácidos são codificados pelo RNA mensageiro durante a etapa de tradução da síntese proteica. As cadeias laterais exibem características químicas distintas – podendo ser apolares, polares, ácidas ou básicas — o que influencia a estrutura tridimensional e, portanto, a função das proteínas.
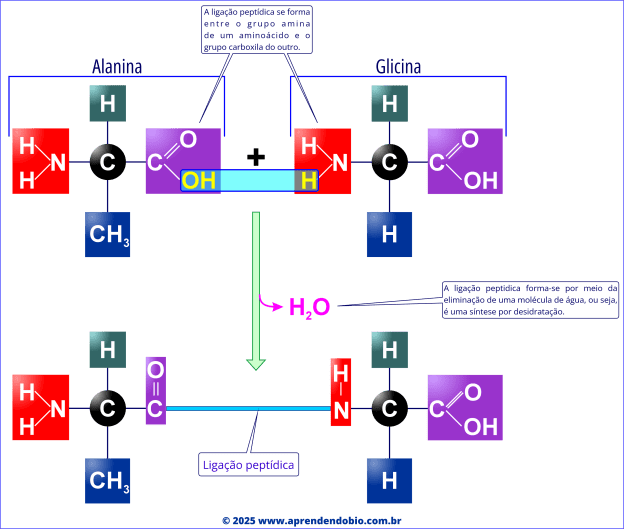
Durante a síntese proteica, a carboxila de um aminoácido reage com o grupo amino de outro, estabelecendo uma ligação covalente conhecida como ligação peptídica. Esse processo ocorre com a eliminação de uma molécula de água, o que caracteriza uma reação de condensação, mais especificamente uma síntese por desidratação.
A sequência linear de aminoácidos — determinada geneticamente — constitui a estrutura primária da proteína. Essa sequência define tanto sua conformação tridimensional quanto sua função biológica. Pequenas alterações na estrutura primária podem comprometer significativamente a capacidade funcional da molécula.
A formação de ligações de hidrogênio entre os grupos amida e carbonila na cadeia polipetídica causam dobras em diversos pontos da estrutura primária. Esse dobramento recebe a denominação de estrutura secundária.
Já as interações entre as cadeias laterais dos aminoácidos — como ligações iônicas, interações hidrofóbicas, pontes de hidrogênio e dissulfeto — resultam um dobramento mais complexo, conferindo à proteína sua conformação tridimensional característica, conhecida como estrutura terciária.
A estrutura terciária representa, portanto, o arranjo espacial completo da cadeia polipeptídica e resulta do dobramento adicional da estrutura secundária, promovido por interações entre as cadeias laterais dos aminoácidos ao longo da cadeia polipeptídica.
Por fim, em muitas proteínas, duas ou mais cadeias polipeptídicas interagem entre si, formando um complexo funcional maior. Essa associação constitui a estrutura quaternária, que depende de interações semelhantes às da estrutura terciária, mas envolvendo diferentes cadeias polipeptídicas.

Enzimas: catalisadores biológicos
As reações químicas que ocorrem nos organismos — como a síntese de moléculas, a liberação de energia e a degradação de substâncias — não atingiriam uma velocidade compatível com as necessidades biológicas se dependessem apenas da espontaneidade termodinâmica. Para que o metabolismo funcione de maneira eficiente e controlada, o papel das enzimas, principais catalisadores biológicos, é indispensável.
Importância das enzimas no metabolismo
As enzimas são catalisadores biológicos que aceleram reações químicas sem serem consumidas nem permanentemente modificadas durante o processo. Na maioria dos casos, tratam-se de proteínas com elevada especificidade por seus substratos, embora também existam catalisadores formados por RNA — as ribozimas — que exercem funções importantes em determinados contextos celulares.
Graças à ação enzimática, transformações que ocorreriam de forma extremamente lenta — em horas ou dias — passam a acontecer em frações de segundo, tornando viável a atividade metabólica dos organismos. Além de aumentar a velocidade, as enzimas possibilitam o controle do metabolismo, permitindo que reações específicas ocorram no momento e local adequados, com grande precisão.
Energia de ativação
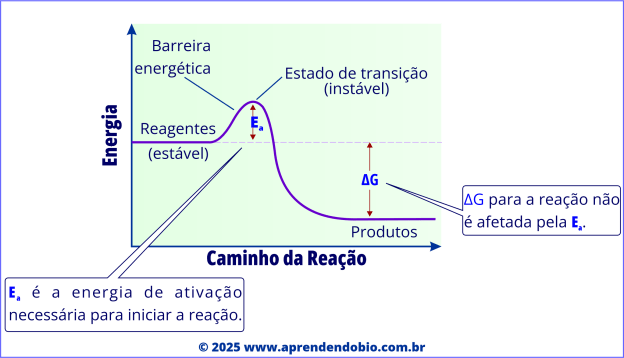
Mesmo quando uma reação é termodinamicamente favorável, ou seja, ocorre liberação de energia útil durante o processo (∆G < 0), ela não acontece instantaneamente. Antes que os reagentes possam ser convertidos em produtos, é necessário atingir um estado molecular altamente instável e energético, conhecido como estado de transição. A energia necessária para alcançar esse ponto é chamada de energia de ativação (Ea).
No gráfico acima, a energia de ativação é representada pela “barreira” entre reagentes e produtos — quanto mais alta ela for, menor a probabilidade de a reação ocorrer espontaneamente em ritmo adequado. O papel da enzima é justamente reduzir essa barreira, facilitando o acesso das moléculas ao estado de transição e, consequentemente, aumentando a velocidade da reação.
A figuras a seguir apresentam uma analogia que ajuda a entender o papel da energia de ativação.
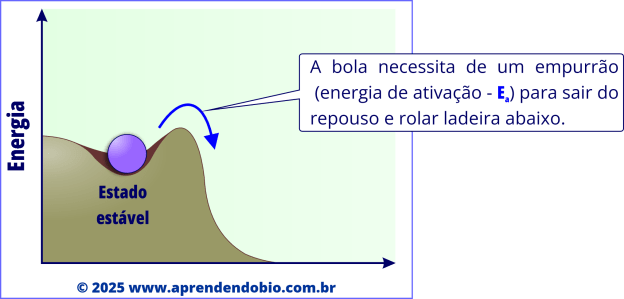
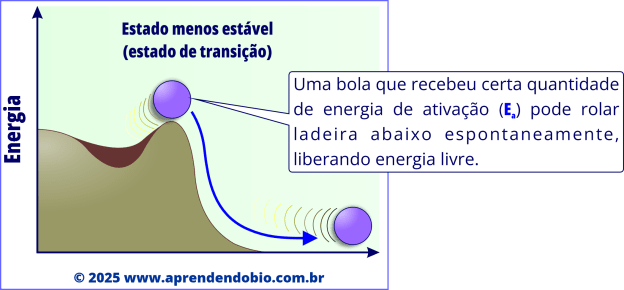
A enzima, ao diminuir a energia de ativação, permite que um número maior de moléculas “suba” até o ponto crítico da reação e “desça” na direção dos produtos, sem alterar o ponto de partida nem o de chegada.
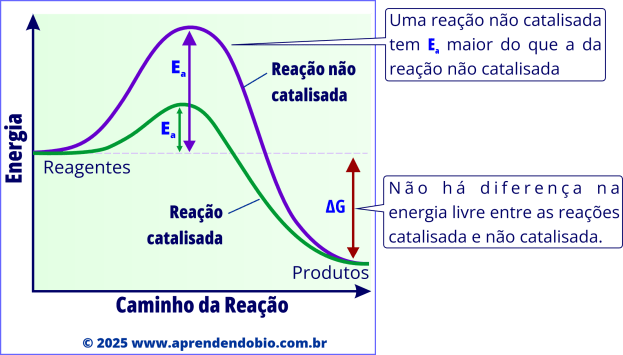
A enzima não altera o valor de ∆G da reação, isto é, não modifica a quantidade de energia livre liberada ou absorvida entre reagentes e produtos. Ela atua exclusivamente sobre a velocidade do processo.
O ∆G, ou variação de energia livre de Gibbs, mede a energia disponível para realizar trabalho químico em condições constantes de temperatura e pressão. Ele indica se uma reação pode ocorrer de forma espontânea. Um ∆G negativo (∆G < 0) significa que os produtos têm menos energia livre do que os reagentes e, portanto, a reação tende a ocorrer naturalmente. Já um ∆G positivo (∆G > 0) indica que a reação requer um fornecimento externo de energia para acontecer.
O ∆G está relacionado com a variação de entalpia (∆H) — que corresponde ao calor liberado ou absorvido — e com a variação de entropia (∆S), que expressa o grau de desordem do sistema.
Dessa forma, o ∆G oferece uma visão mais completa do comportamento energético de uma reação: enquanto ∆H se limita ao aspecto térmico, ∆G considera também a organização molecular do sistema, sendo a medida definitiva para prever se uma transformação será ou não espontânea.
As enzimas, portanto, são catalisadores extraordinários não por alterarem o destino energético da reação, mas por tornarem seu caminho mais acessível.
Sítio ativo e especificidade enzimática
A catálise enzimática ocorre em uma região específica da molécula, conhecida como sítio ativo. É nesse local que o substrato se liga à enzima, de forma altamente seletiva. Essa especificidade resulta da compatibilidade entre as características estruturais e químicas da enzima e do substrato, o que permite que apenas determinadas moléculas se ajustem adequadamente ao sítio catalítico.
Dois modelos foram propostos para explicar essa interação. O primeiro, chamado modelo chave-fechadura, sugere que o substrato se encaixa no sítio ativo com precisão pré-definida, como uma chave que corresponde exatamente ao contorno da fechadura.
No entanto, o modelo atualmente mais aceito é o do encaixe induzido. Segundo essa proposta, a ligação do substrato provoca uma modificação conformacional na enzima, que ajusta sua estrutura tridimensional para acomodar o substrato com mais eficiência. Essa flexibilidade permite uma interação mais eficaz e ajuda a estabilizar o estado de transição durante a catálise.
Mecanismo de ação enzimática
Antes de analisar como as enzimas atuam, é importante destacar um aspecto essencial: a presença da enzima não altera o produto da reação. A substância que será formada ao final do processo é a mesma, com ou sem a enzima. A diferença está no tempo necessário para que a reação ocorra.
A imagem acima ilustra a transformação direta de reagentes em produto sem a participação de enzimas. Esse processo é possível, mas muitas vezes lento e ineficiente sob condições fisiológicas.
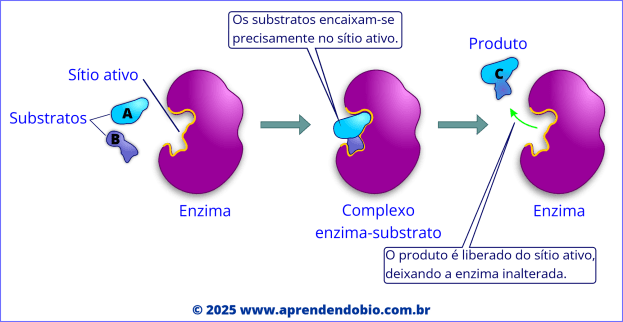
Nos sistemas biológicos, como no interior das células, essa mesma transformação é acelerada graças à ação das enzimas. A reação se inicia com o encaixe do substrato no sítio ativo da enzima, formando o complexo enzima-substrato. Esse complexo temporário favorece a conversão química.
Durante essa etapa, a enzima posiciona corretamente os reagentes, estabiliza o estado de transição, e pode também fornecer um microambiente com condições químicas ideais, como regiões com polaridade ou pH ajustados para favorecer a reação.
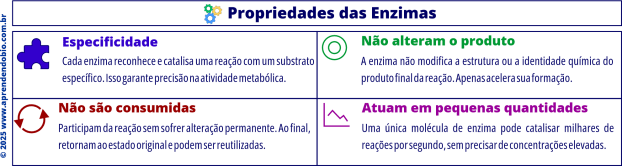
Após a conversão do substrato, os produtos são liberados, e a enzima retorna ao seu estado original, apta a repetir o processo com novas moléculas. Esse caráter reutilizável é uma das propriedades mais distintivas das enzimas: elas não são consumidas na reação.
Além disso, atuam em pequenas quantidades, já que uma única molécula de enzima pode catalisar a transformação de milhares de substratos em sequência.
Como visto, elas não alteram a natureza química do produto — o que muda é apenas a velocidade da conversão, e não o resultado final da reação.
As enzimas também apresentam elevada especificidade, reconhecendo e interagindo apenas com determinados substratos, o que garante precisão às vias metabólicas.
Em muitos casos, também podem catalisar reações reversíveis, atuando nos dois sentidos, conforme as concentrações relativas de reagentes e produtos. No entanto, dentro da célula, a reversão nem sempre ocorre, pois os produtos são frequentemente consumidos rapidamente na reação seguinte, o que direciona o fluxo metabólico para um único sentido.
Essas propriedades — especificidade, eficiência em pequenas quantidades, reutilização, não alteração do produto e, em certos contextos, reversibilidade — tornam as enzimas componentes essenciais para a organização e o controle das reações químicas que sustentam os processos biológicos.
Desnaturação e perda de função enzimática
A atividade de uma enzima depende diretamente de sua conformação tridimensional. Fatores como variações de temperatura, alterações de pH ou presença de substâncias desestabilizadoras podem comprometer a integridade estrutural da enzima. Esse processo, denominado desnaturação, leva à perda da forma do sítio ativo, tornando a enzima funcionalmente inativa.
A relação entre estrutura e função é tão estreita que, mesmo uma alteração mínima pode inviabilizar a atividade catalítica. Isso reforça o papel fundamental da estrutura terciária — e, em muitos casos, quaternária — na eficiência catalítica das enzimas.
Fatores que influenciam a atividade enzimática
A atividade das enzimas está diretamente relacionada às condições do meio em que atuam. Por dependerem de interações moleculares específicas e de uma estrutura tridimensional funcional, enzimas são sensíveis a variações em fatores como concentração de substrato, temperatura e pH. Tais variações podem aumentar ou reduzir a eficiência catalítica, e em casos extremos, inativar a enzima por desnaturação.
Concentração do substrato
Em um meio onde há enzima disponível, o aumento progressivo da concentração do substrato tende, inicialmente, a elevar a velocidade da reação. Isso ocorre porque mais moléculas de substrato encontram as enzimas livres, formando mais complexos enzima-substrato por unidade de tempo.
Contudo, esse crescimento da atividade não é indefinido. À medida que todos os sítios ativos das enzimas ficam ocupados, atinge-se uma condição chamada saturação enzimática. A partir desse ponto, mesmo com o aumento da concentração do substrato, a taxa de reação se mantém constante, pois não há mais sítios disponíveis para acomodar novas moléculas.

A curva apresentada ilustra claramente esse comportamento: crescimento inicial rápido, seguido por uma estabilização em um platô correspondente à atividade máxima da enzima.
Temperatura
A temperatura exerce um papel determinante sobre a atividade das enzimas por afetar diretamente a energia cinética das moléculas envolvidas. À medida que a temperatura se eleva, as moléculas de enzima e substrato movem-se mais rapidamente, o que aumenta a frequência e a intensidade das colisões entre elas. Esse aumento na mobilidade molecular favorece a formação do complexo enzima-substrato, acelerando a conversão dos reagentes em produtos.
Contudo, esse efeito só se mantém até certo ponto. Cada enzima apresenta uma temperatura ótima, geralmente próxima da temperatura fisiológica do organismo onde atua, na qual a velocidade da reação catalisada atinge seu máximo. Esse pico de atividade representa um equilíbrio entre a agitação térmica suficiente para promover colisões eficazes e a manutenção da estrutura tridimensional estável da enzima.
Acima dessa faixa ideal, o excesso de energia térmica começa a romper as interações não covalentes (como pontes de hidrogênio, interações hidrofóbicas e ligações iônicas) que mantêm a estrutura tridimensional da proteína. O resultado é a desnaturação, processo no qual a enzima perde sua estrutura nativa e, consequentemente, o formato do sítio ativo. Sem esse encaixe preciso, a enzima torna-se funcionalmente inativa.
Como é possível observar na figura, a atividade enzimática aumenta gradualmente com a elevação da temperatura até atingir um ponto máximo — a temperatura ótima. A partir daí, a atividade cai bruscamente, indicando a perda da funcionalidade enzimática por desnaturação.
pH
O pH do meio exerce influência direta sobre a atividade das enzimas por afetar tanto a estrutura tridimensional da proteína quanto as propriedades químicas do sítio ativo e do substrato.
Cada enzima possui uma faixa restrita de pH na qual sua configuração molecular é mais estável e sua afinidade pelo substrato é maximizada. Dentro dessa faixa, encontramos o chamado pH ótimo, valor que representa as condições ideais para a catálise ocorrer com máxima eficiência.
A ação enzimática depende de interações químicas específicas — como pontes de hidrogênio, interações eletrostáticas e ligações iônicas — que ocorrem entre os aminoácidos no sítio ativo e o substrato. Essas interações, por sua vez, estão fortemente ligadas ao estado de ionização dos grupos funcionais envolvidos, como carboxilas (–COOH/–COO⁻) e aminas (–NH₃⁺/–NH₂).
Quando o pH se desvia dos valores ideais, esses grupos podem ganhar ou perder prótons (H⁺), alterando suas cargas elétricas. Isso pode comprometer o encaixe molecular, interferir na estabilização do estado de transição ou até mesmo impedir a formação do complexo enzima-substrato.
Em situações mais extremas, tanto em meio muito ácido quanto muito básico, o pH pode afetar a estabilidade da estrutura enzimática inteira, rompendo interações que mantêm sua conformação funcional. Isso leva à desnaturação, fenômeno que impede a catálise por perda da forma do sítio ativo.
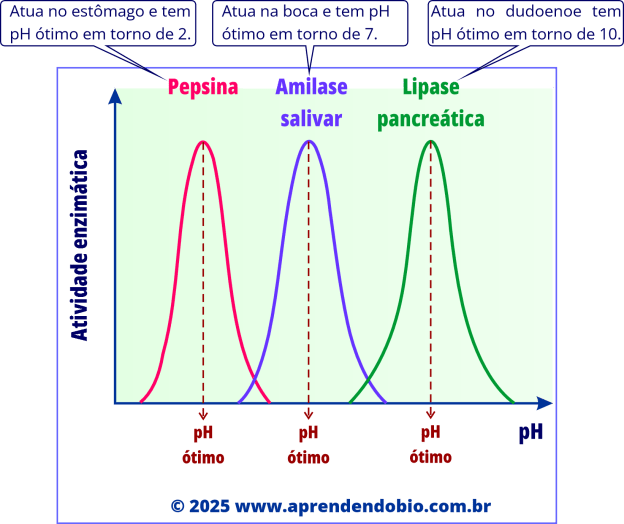
A figura ilustra a sensibilidade ao pH para três enzimas digestivas, cada uma adaptada ao ambiente em que atua. A pepsina, presente no estômago, exibe atividade máxima em torno de pH 2, compatível com o ambiente ácido gástrico. A amilase salivar, ativa na cavidade oral, tem desempenho ideal em pH neutro (cerca de 7). Já a lipase pancreática, que atua no duodeno, funciona melhor em pH alcalino, em torno de 10. Esses exemplos mostram que o pH ideal de uma enzima está diretamente relacionado ao contexto fisiológico em que ela atua.
A questão apresenta uma tabela com os resultados de seis experimentos que investigam a atividade da enzima catalase na decomposição do peróxido de hidrogênio (H₂O₂), variando apenas a temperatura. O objetivo é identificar, com base nos dados fornecidos, a justificativa bioquímica para a variação observada na taxa de decomposição, ou seja, qual fator explica a diferença na atividade enzimática conforme a temperatura em cada experimento.
A análise dos dados apresentados mostra que a decomposição do peróxido de hidrogênio (H₂O₂) catalisada pela enzima catalase apresenta variações significativas conforme a temperatura é alterada.
Observa-se que a atividade enzimática aumenta inicialmente com a elevação da temperatura, atinge um valor máximo a 15 °C e, a partir desse ponto, começa a decrescer de forma progressiva.
Essa tendência sugere que a enzima atua com maior eficiência dentro de uma faixa térmica específica e perde atividade quando submetida a temperaturas mais elevadas.
A variação no desempenho da enzima não pode ser atribuída a alterações no pH do meio (alternativa A), pois o texto base informa claramente que as condições dos ensaios foram mantidas constantes, sendo a temperatura a única variável controlada. Portanto, a hipótese de mudança no pH é descartada por não corresponder às condições experimentais.
A alternativa B, que propõe um aumento da energia de ativação, também não é válida. A energia de ativação é uma propriedade da reação química em si, e o papel da enzima é justamente reduzir essa barreira energética. O aumento da temperatura, por si só, não implica um aumento da energia de ativação, mas sim maior energia cinética das moléculas. No entanto, o que os dados mostram é uma perda de atividade em temperaturas elevadas, o que não se explica por um suposto aumento da energia de ativação, mas sim por outro fator que afeta diretamente a estrutura da enzima.
A opção C sugere que a enzima foi consumida durante o ensaio, o que não condiz com a natureza da catálise enzimática. As enzimas não são consumidas ao longo das reações que catalisam. Elas participam temporariamente do processo e retornam ao seu estado original ao final da reação. Assim, a queda na atividade observada nos ensaios posteriores não pode ser explicada por uma suposta redução na quantidade de enzima.
A alternativa D considera a possibilidade de que a concentração do substrato tenha diminuído. Contudo, o texto base informa que todas as condições experimentais, exceto a temperatura, foram mantidas constantes. Isso inclui, portanto, a concentração de H₂O₂. Sendo assim, essa opção está incorreta.
A alternativa E propõe a ocorrência de modificação da estrutura tridimensional da enzima, o que corresponde ao fenômeno de desnaturação. Essa explicação é compatível com os dados observados. Em temperaturas mais elevadas, especialmente acima da faixa ótima, as interações responsáveis pela estrutura tridimensional da proteína começam a ser rompidas, o que altera a forma do sítio ativo e compromete sua capacidade de catalisar a reação. A queda acentuada na atividade catalítica a partir de 20 °C sugere que a estrutura da catalase foi afetada de modo a reduzir sua eficiência — resultado típico da desnaturação. Portanto, essa é a única alternativa que oferece uma explicação compatível com os princípios do mecanismo de ação enzimática e com os dados apresentados.
Apoie a continuidade deste conteúdo científico
Se esta explicação ajudou você a entender por que a catalase perde eficiência quando sua estrutura tridimensional é modificada pela temperatura, considere apoiar o Aprendendo Biologia.
Gestos simples — compartilhar, divulgar ou contribuir financeiramente — fortalecem a produção independente de conteúdo, ampliam a rede de aprendizagem e mantêm a educação científica acessível.
📩 Chave Pix: contato@aprendendobio.com.br

Obrigado por apoiar a educação científica com propósito!
Saiba mais