A terapia gênica representa uma das estratégias mais avançadas da biotecnologia moderna, especialmente quando aplicada ao tratamento de doenças hereditárias que afetam tecidos altamente especializados. No caso das distrofias da retina causadas por mutações no gene RPE65, a transferência de uma cópia funcional desse gene por meio de vetores virais oferece uma forma de restaurar processos bioquímicos essenciais à visão. A relevância desse tema e sua conexão com os conceitos de biotecnologia justificam sua presença em questões do ENEM.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou um produto de terapia gênica no país, indicado para o tratamento da distrofia hereditária da retina. O procedimento é recomendado para crianças acima de 12 meses e adultos com perda de visão causada pela mutação do gene humano RPE65. O produto, elaborado por engenharia genética, é composto por um vírus, no qual foi inserida uma cópia do gene normal humano RPE65 para corrigir o funcionamento das células da retina.
ANVISA. Disponível em: http://www.gov.br/anvisa. Acesso em: 4 dez. 2021 (adaptado).
O sucesso dessa terapia advém do fato de que o produto favorecerá a
A) correção do código genético para a tradução da proteína.
B) alteração do RNA ribossômico ligado à síntese da proteína.
C) produção de mutações benéficas para a correção do problema.
D) liberação imediata da proteína normal na região ocular humana.
E) expressão do gene responsável pela produção da enzima normal.
DISTROFIA HEREDITÁRIA DA RETINA
A distrofia hereditária da retina não é, na realidade, uma única doença, mas sim um conjunto de enfermidades genéticas que causam a degeneração progressiva das células da retina. Essas doenças resultam de mutações em genes essenciais ao funcionamento das células fotorreceptoras (cones e bastonetes), responsáveis pela captação da luz e, portanto, indispensáveis à visão.
Um desses genes é o RPE65, que desempenha papel estratégico em um processo bioquímico essencial para a visão. O RPE65 codifica uma enzima de mesmo nome, responsável por uma etapa-chave na reciclagem do retinol (vitamina A). Essa etapa é indispensável para a regeneração do pigmento 11-cis-retinal, molécula necessária à ativação das células fotorreceptoras da retina, sendo, portanto, fundamental para o funcionamento visual normal.
Quando há uma mutação nesse gene, a produção da enzima RPE65 é prejudicada, interrompendo esse ciclo bioquímico. Como consequência, os fotorreceptores deixam de funcionar corretamente, resultando em perda progressiva da visão. Com o tempo, essa falha funcional prolongada leva à degeneração estrutural das células da retina — ou seja, os fotorreceptores não apenas deixam de funcionar, mas também entram em apoptose (morte celular programada), o que agrava ainda mais a perda visual e pode levar à cegueira total.
Portanto, a falha no gene RPE65 compromete diretamente a função visual, e essa disfunção prolongada é que leva à degeneração progressiva da retina. Trata-se de um processo em dois estágios: primeiro ocorre a perda funcional, seguida pela deterioração estrutural.
TERAPIA GÊNICA
Até recentemente, não havia cura para a distrofia hereditária da retina causada por mutações no gene RPE65. Os tratamentos disponíveis eram apenas paliativos, com o objetivo de melhorar a qualidade de vida dos pacientes. Esses procedimentos visavam amenizar os sintomas e retardar a progressão da perda visual, mas não atuavam sobre a causa genética da doença.
Com os avanços da biotecnologia, surgiu a terapia gênica, representando um marco no tratamento das distrofias hereditárias da retina. Essa abordagem inovadora tornou possível intervir diretamente na origem molecular do problema, restaurando a produção da enzima RPE65 e reativando o ciclo visual.
A estratégia consiste em introduzir uma cópia funcional do gene RPE65 diretamente nas células da retina, utilizando um vetor viral seguro. Esse processo envolve uma sequência de etapas altamente controladas, que garantem tanto a precisão da entrega gênica quanto a eficácia terapêutica.
Etapa 1. Preparação do Vetor Viral
O primeiro passo é a construção de um vetor viral recombinante, utilizando o vírus adeno-associado (AAV), amplamente reconhecido por sua segurança e baixa imunogenicidade. O vetor é modificado para carregar uma cópia funcional (selvagem) do gene humano RPE65, sendo incapaz de se replicar no organismo.
Essa cópia é inserida sob o controle de um promotor específico, que garante a expressão seletiva do gene terapêutico nas células do epitélio pigmentar da retina (EPR) — local onde o RPE65 é normalmente expresso.
Após sua montagem, o vetor passa por processos rigorosos de purificação, eliminando quaisquer resíduos virais ou celulares. Em seguida, sua titulação — isto é, a medição precisa da quantidade de partículas virais por volume — é cuidadosamente ajustada, assegurando que a dose administrada ao paciente seja exata, segura e eficaz.
Etapa 2. Inoculação do Vetor
Após o preparo, o vetor é injetado diretamente no espaço subretiniano, ou seja, entre a retina neurossensorial e o epitélio pigmentar da retina (EPR).
Esse procedimento cria um pequeno descolamento localizado da retina (conhecido como “bleb”) que permite o contato do vetor com as células-alvo. Nesse ambiente controlado, o vetor AAV penetra nas células do EPR, iniciando o processo de transdução gênica, que permite a entrada do DNA terapêutico nas células.
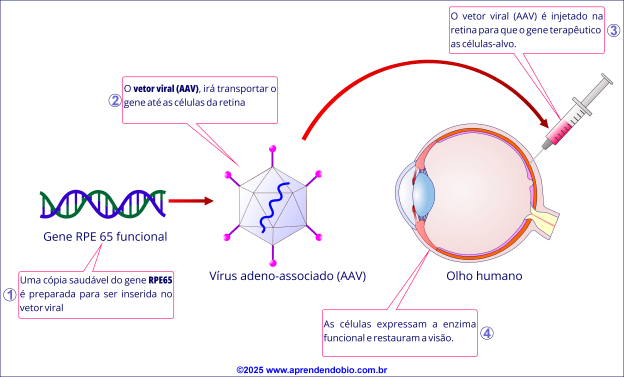
Etapa 3. Ação Intracelular
Dentro do núcleo das células do EPR, o DNA do AAV permanece em forma epissomal, ou seja, fora do genoma celular, evitando os riscos associados à integração gênica, como mutações indesejadas.
Importante: O gene original, defeituoso, continua presente no DNA do paciente. A terapia gênica não edita, bloqueia nem substitui o gene mutado. Em vez disso, ela adiciona uma cópia funcional do gene RPE65, capaz de suprir a deficiência enzimática causada pela mutação.
Esse gene funcional é então transcrito em RNA mensageiro (RNAm) e traduzido em proteína RPE65 funcional, a enzima necessária para a restauração do ciclo visual.
A enzima produzida catalisa a produção 11-cis-retinal, molécula essencial para regenerar os pigmentos visuais nos bastonetes, que são os fotorreceptores especializados na visão em baixa luminosidade.
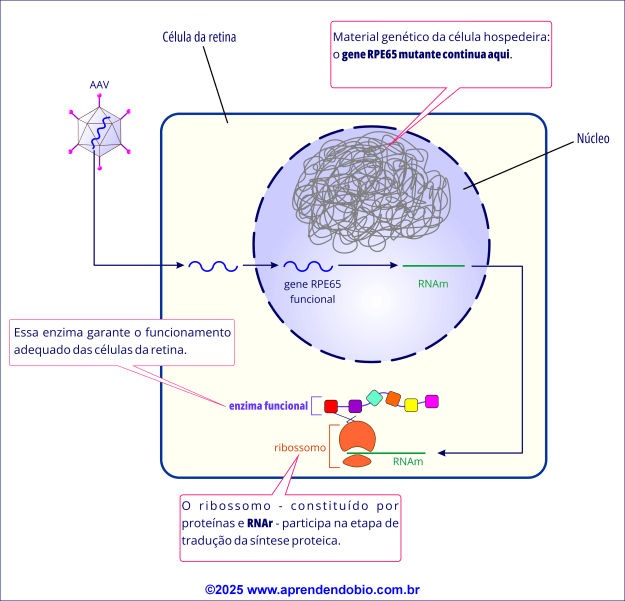
A terapia gênica permite que os fotorreceptores voltem a responder à luz, promovendo uma melhora da sensibilidade visual, ampliação do campo visual e, em alguns casos, aumento da acuidade visual.
Embora não reverta danos estruturais já estabelecidos, a terapia pode interromper ou retardar a progressão da doença, sendo especialmente eficaz quando aplicada em estágios precoces, nos quais ainda há fotorreceptores viáveis.
A questão descreve uma terapia gênica aprovada pela Anvisa para tratar distrofia hereditária da retina, causada por mutações no gene RPE65. O produto consiste em um vetor viral no qual foi inserida uma cópia funcional do gene RPE65, com o objetivo de restaurar o funcionamento das células da retina.
Como visto, esse tipo de terapia não edita ou substitui o gene mutado, mas adiciona uma cópia funcional do gene RPE65, que passa a ser expressa pelas células do epitélio pigmentar da retina (EPR). A expressão permite a produção da enzima RPE65 funcional, ausente ou defeituosa nos pacientes com mutações nesse gene.
A enzima RPE65 é indispensável para o ciclo visual, pois catalisa a produção do pigmento visual 11-cis-retinal, necessário para o funcionamento dos bastonetes (fotorreceptores responsáveis pela visão em baixa luminosidade). Assim, ao promover a expressão do gene funcional, a terapia possibilita a restauração parcial da função visual
Portanto, o sucesso da terapia se dá pelo fato de que a nova cópia do gene introduzido passa a ser expressa, permitindo que a célula volte a produzir a enzima necessária para o ciclo visual.
É justamente esse mecanismo que torna correta a alternativa E, pois a terapia promove a expressão do gene responsável pela produção da enzima normal.
As demais alternativas não correspondem ao funcionamento da técnica descrita:
A alternativa A, que sugere uma correção do código genético, está incorreta, pois não há edição gênica, substituição ou reparo do gene defeituoso original.
A alternativa B afirma que a terapia altera o RNA ribossômico, o que também está incorreto, já que esse tipo de RNA não é modificado. O que ocorre é a produção de RNA mensageiro (RNAm) a partir do gene funcional inserido.
A alternativa C erra ao afirmar que a terapia envolve a produção de mutações benéficas. A técnica não induz mutações — ela simplesmente fornece uma cópia saudável do gene que passa a ser expressa.
Já a alternativa D menciona a liberação imediata da proteína normal, o que não é compatível com o processo real. A proteína não é aplicada diretamente, mas produzida pelas próprias células do paciente após a expressão do gene inserido.
Assim, a alternativa E é a única compatível com o mecanismo da terapia gênica com AAV para o gene RPE65.
🧬 O conhecimento se fortalece quando permanece acessível
Se esta explicação ajudou você a entender como a terapia gênica com AAV restabelece a expressão do gene RPE65 e recupera etapas essenciais do ciclo visual, considere apoiar o Aprendendo Biologia.
Gestos simples — compartilhar, divulgar ou contribuir financeiramente — fortalecem a produção independente de conteúdo, ampliam a rede de aprendizagem e mantêm a educação científica acessível.
📩 Chave Pix: contato@aprendendobio.com.br

Obrigado por apoiar a educação científica com propósito!
Saiba mais





